基因體研究中心翁啟惠院士所領導的研究團隊和楊懷壹老師合作,利用新發展的基因突變及快速轉譯篩選技術,運用多階段統計模式,建立一種可根據五顆胺基酸序列,預測蛋白質上醣化位置及效率的演算法,並且能成功地應用在其他醣蛋白上。此研究發表在「美國化學會期刊 (Journal of the American Chemical Society)」。
人體蛋白質有一半以上帶有醣分子,而醣分子接在天冬醯胺 (asparagine, N) 的胺基酸上( (N-醣基化)是一種很重要的蛋白質轉譯修飾步驟,可以調控醣蛋白的三度結構及多種功能和影響醣蛋白藥物的發展。目前已知N-醣基化經常發生在N-X-S/T的胺基酸序列[N: 天冬醯胺, X: 任何一種氨基酸除了脯氨酸 (proline, P),T: 蘇胺酸 (serine),S: 絲胺酸 (threonine)],但是在含有這三個胺基酸序列的醣蛋白質當中只有65%會被接上醣分子,並且醣基化的效率並不清楚。在蛋白質資料庫當中也有許多未被實驗證明是否實際有接上醣基。因此如何更準確的預測蛋白質的醣化位置與效率進而改造胺基酸序列,在醣蛋白的設計過程當中成為一個重要的課題。
蛋白質藥物發展逐年快速成長,過去蛋白質藥物多由大腸桿菌以及中國倉鼠卵巢 (CHO) 細胞生產,前者雖然可以大量製造但缺乏N-醣基化,後者雖有N-醣基化,但非為人類細胞生產出的醣蛋白;此外,目前無法預測或改變醣化的效率。因此,如何促進醣基化以便改善醣蛋白藥物的穩定性和活性是醣蛋白藥物發展的新趨勢。其中最著名的例子,是安進藥廠 (Amgen) 增加紅血球生成素 (erythropoietin; EPO) 的醣化,從原本三個醣化位置增加至五個位置,結果大幅改善此藥物的穩定性以及其活性。
過去,翁院士與Scripps研究院 Jeffery Kelly 教授曾經合作研究指出,三個胺基酸構成的片段 N-X-S/T 雖為寡糖轉移酶 (oligosaccharyltransferase,簡稱OST; 將N-醣基化前驅物接上胺基酸的酵素) 最簡單的受質,但是,如果在其鄰近上游位置有phenylalanine (F),構成如 F-X-N-X-T 和F-X-X-N-X-T兩種序列,卻可以促進醣化的效率,因而進一步了解部分胺基酸組成對於醣化的影響 (Science 2011, vol 331:571; JACS 2013, vol 135:9877)。
為了要深入的解析醣化的Asn附近的其他胺基酸,是否會影響醣基化的效率,研究團隊使用人類T細胞上抗原蛋白CD2的黏著片段作為實驗模型,利用新設計的基因突變及快速轉譯篩選技術,搭配多階段統計模式分析 (圖一),來檢視醣基化N (i) 附近其他胺基酸 (i-2, i-1, i+1, i+2) 是否會影響其效率。
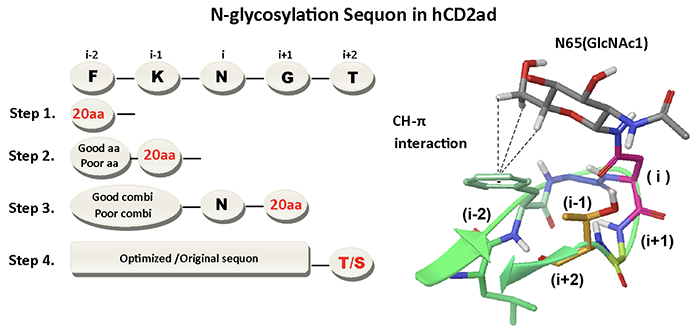 |
| 圖一 |
研究團隊發現(圖二),在醣化的N上游前第二個位置 (i-2) 若為帶有芳香環官能基,特別是色胺酸 (W) 和硫官能基的胺基酸,可以促進醣化的效率,若為帶有正電的胺基酸,則具有相反的效果;在i-1的位置的胺基酸,若是具有硫、氫氧、脂肪族等官能基,會有較高的醣化效率,尤其是在i-1位置為半胱胺酸 (C) 時,即使是在i-2位置有精胺酸 (R) 這種不利醣化的胺基酸,仍可以有效地恢復醣化效率;此外,小分子量的胺基酸或絲胺酸(S) 位在i+1的位置時,可以有效地促進醣化的效率,而i+2 的T 比 S 更能促進醣化。
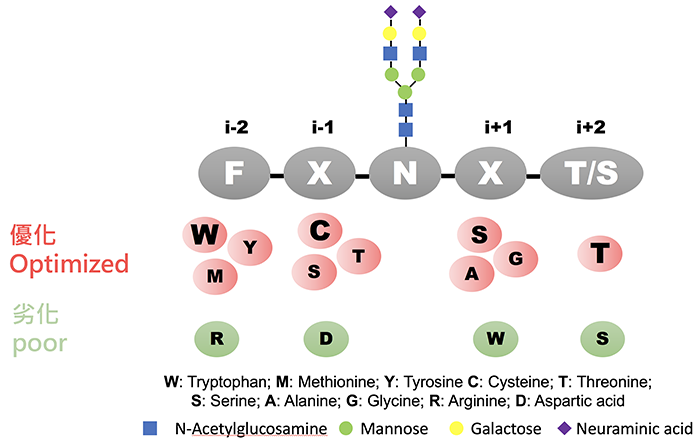 |
| 圖二 |
根據這些不同胺基酸組合及其醣化效率資料,在具有流行病學風險預測分析專長的楊懷壹老師協助之下,研究人員利用統計模式分析,建立了一套演算法,可以根據胺基酸的組合來預測醣化的效率。
為了證明優化片段能夠促進醣化的位置與效率,並可在其他具有N-醣基化的蛋白中利用優化片段置換原本的片段,結果促進醣化效率和人類CD2模型的結果一致;研究團隊進一步與吳盈達老師合作,使用電腦模擬的方式,結果發現,優化片段和人類OST亞基 (STT3A) 具有高度的親和力和相互作用。
這個研究結果提供了一個預測N-醣基化效率的指引,可以針對有興趣的醣化蛋白或抗體上的醣化位置進行基因工程,以促進或是抑制醣化的效率。此研究讓科學家對於OST所催化的醣化有更進一步的了解。
研究團隊表示:「根據這些分析,我們可以瞭解N-醣基化過程中,效率好以及不好的胜肽受質。此外,和統計分析學者跨領域合作建立的演算法,讓我們能夠依據不同蛋白質的序列,計算出最合適的五個胺基酸排列,來調整醣化效率,並減少因改變胺基酸而造成蛋白結構改變的影響度。此研究成果可以應用於增加蛋白藥物的醣基化以促進其活性以及穩定性。我們的模型也提供了一個新的想法:如果基因突變造成了醣基化N附近的胺基酸的改變,將改變該蛋白的醣化程度,因而造成疾病的產生。」
此研究成果「Residues Comprising the Enhanced Aromatic Sequon Influence Protein N-glycosylation Efficiency」已發表於「美國化學會期刊 (Journal of the American Chemical Society)」 (DOI: 10.1021/jacs.7b03868),第一作者為畢業於國立台灣大學生化科學研究所的黃彥文博士。
 |
| 研究團隊(由左至右):楊懷壹博士、黃彥文博士、徐翠玲博士與林子文博士。 |