The progress of Next-Generation Sequencing (NGS) as a research and diagnostic tool has stirred excitement lately worldwide. Dr. Kuo-Ping Chiu, an Associate Research Fellow at Genomics Research Center, has contributed another piece of good news to the scientific world by reporting in the January 17, 2017 issue of Scientific Reports journal an innovative approach which not only can amplify minute DNA for DNA sequencing, but potentially can be used for DNA-based diagnosis.
The study of Genomics has come a long way. We now know that DNA is the basic information-storage material for coding our genes. Aside from the forensic dramas that we watch on television, DNA studies play a major role in new therapeutics.
What you may not know is that, if you give the lab a tube of your blood, a drop of your saliva or urine to examine, besides the cells, the genomics scientist could find tiny amount of small DNA fragments that are not just from your normal cells, but, possibly from microbial intruders, like bacteria, or even more, from diseased tumor cells in your body. These are called circulating cell-free DNA, or simply cfDNA. This is because at the end of a cell life cycle, the cell falls apart, small pieces of DNA may flow into the blood stream and go with the flow.
Can cfDNA of a tumor cell travel inside our body and make impacts? Can we make detecting cfDNA segments of tumor cells in blood as a diagnostic method? If so, that will be a much better way compared to current biopsy procedures, because it is a noninvasive and a convenient way to provide us very detailed information regarding our health conditions. These are questions worth pounding, and yet, in order to dig into it, one needs to have cfDNA fragments in a meaningful quantity.
However, using the utmost facility currently available, a minimum of 0.5 nano-gram in quantity is needed. So far, there is no way to sequence tiny traces of DNA segments in body fluid.
According to Dr. Chiu, in a collaborative study on early onset breast cancer (EOBC) with Dr. Alice L. Yu, an idea to come up with a better PCR method to make copies of tiny traces of cfDNA molecules emerged (Fig. 1).
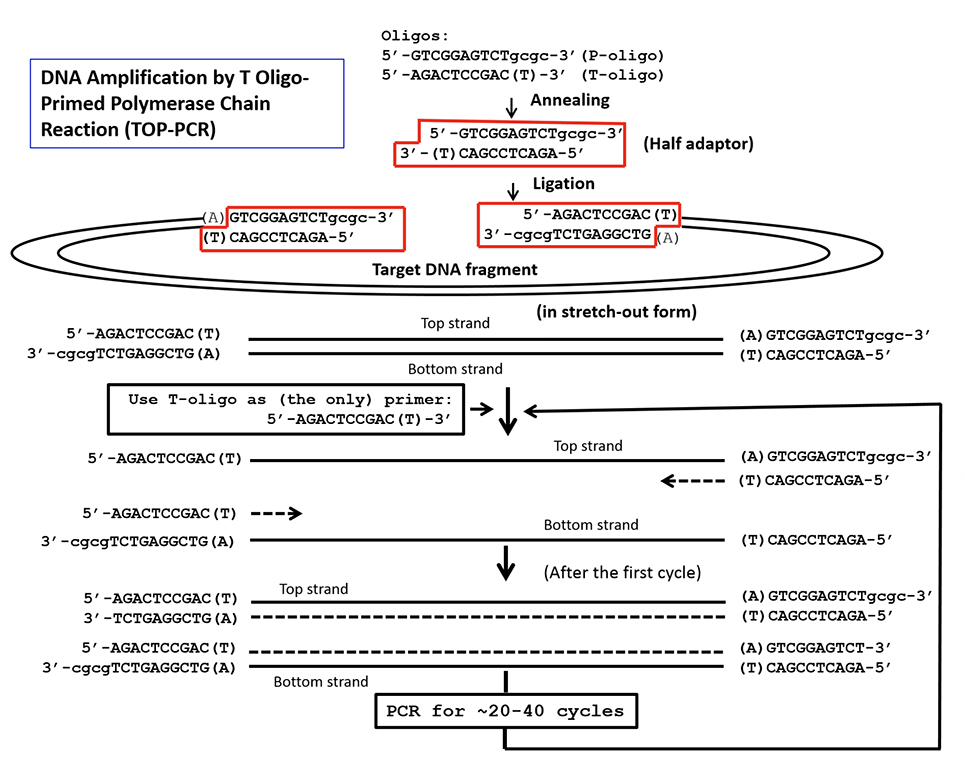 |
| Fig. 1. Procedure of T oligo-primed polymerase chain reaction (TOP-PCR). Half adaptor is generated by annealing P and T oligos. P oligo carries a 5’ phosphate required for ligation to target DNA fragments, while T oligo does not. During amplification, only the T oligo serves as the PCR primer. Number of amplification cycle depends on the initial concentration of the target DNA molecules and the desired final quantity. |
PCR, abbreviated from Polymerase Chain Reaction, is a crucial step prior to the sequencing job. When technicians obtain the body fluid samples, they have to first isolate the DNA fragments to be examined. However, usually the amount of DNA that are extracted are not enough, thus PCR comes to play. To make it simple, PCR is like a copying machine for DNA fragments.
Yet not all PCRs are created equal for liquid biopsy! To be able to copy the DNA fragments, scientists need first add molecules at both ends to encapsulate them. Such molecules can be referred to as the ‘adaptor’. After the adaptors are in place, they would add specially designed ‘primers’ inside the PCR machine to carry out the amplification work. Each primer is kind like a pointer to indicate the starting point in the DNA string for the duplication work. Conventional methods failed when the sample DNA amount is low, because while duplicating, current methods tend to aggregate the adaptors themselves (Fig. 2, left panel).
As a result, by a redesigned PCR method, “T Oligo-Primed Polymerase Chain Reaction” was successfully created by Chiu’s team, and it is referred to as TOP-PCR. In it, Chiu’s team created an adaptor consists of P oligo and T oligo, and the T Oligo alone is also used as the PCR primer (Fig. 1).
With this approach, the team has demonstrated a whopping leap as far as sample requirement is concerned. For only 0.01 pico-gram DNA from blood plasma, that is 1/50,000 of conventional requirement, they are able to trap the DNA and amplify it to a quantity justifiable for research work (Fig 2, right panel). Furthermore, the completeness of catching DNA fragments can be reached by TOP-PCR at a 70% rate, while conventional method at the same condition provides only roughly 40% or less.
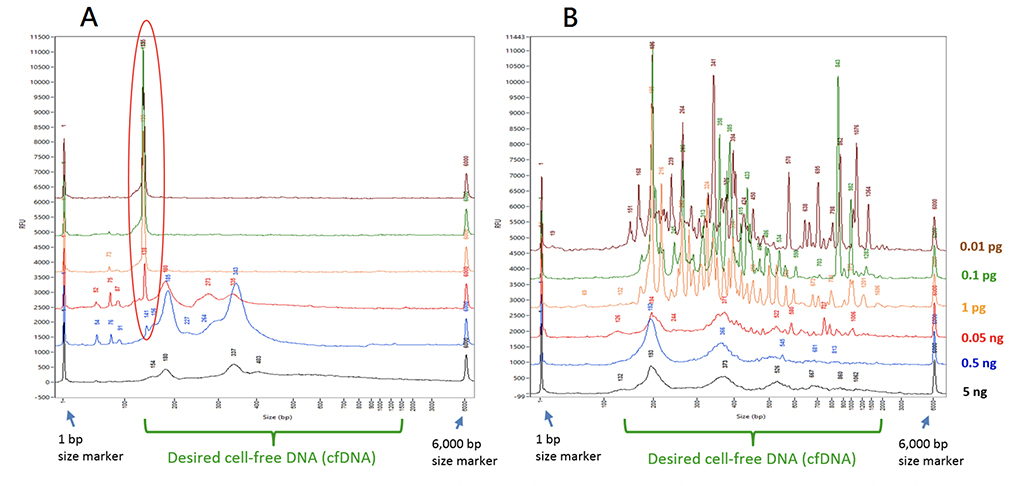 |
| Fig. 2. Comparison of TOP-PCR and Illumina PCR. |
"TOP-PCR makes two major breakthroughs: First of all, the minimum quantity requirement (0.5 ng) for DNA sequencing is demolished; furthermore, even above 0.5 ng, the sensitivity of TOP-PCR is about two times better than the traditional method. Thus, it creates tremendous potential for diagnostics. The next step is to use the technology in clinical applications via collaborations with diagnostics industry and sequencing industry." Dr. Chiu said.
It is easily foresee that TOP-PCR may be able to open up a door for early diagnosis. Prior to this invention, there is no way to detect the rare cancer suspects flowing in the body fluids, with or without conventional sequencing devices. It also has the potential being used to monitor cancer metastasis, viral infections or even prenatal genetic diagnosis.
The method has been patented prior to the publication in Scientific Reports. Details of the study can be read online at: http://www.nature.com/articles/srep40767.
 |
| Fig. 3. Team members (from left): Yenju Chen, Tzu-Han Chen, Dr. Kuo-Ping Chiu, Dr. Hsin-Chieh Shiau, Dr. Yu-Shin Nai, Dr. Yu-Feng Huang. |