Among gynecological cancers, ovarian cancer (OC) has received less attention compared to breast cancer and cervical cancer. According to the 2017 Cancer Registration Report of the Ministry of Health and Welfare, for every 100,000 persons, there are 9.2 new OC cases in Taiwan every year. Compared to breast cancer (78.9 new cases per 100,000 persons), OC is less prevalent. However, OC is one of the leading causes of cancer death in women. The overall 5-year survival rate for OC is lower than 50%. Due to a lack of specific symptoms and early detection methods, most OC patients are diagnosed after the cancer has spread. The 5-year survival rate at this late stage is below 30%.
Understanding how OC develops and progresses is essential to improve patient survival. However, this is particularly challenging for OC due to its heterogeneity, which includes five major histotypes, and complex biology. Among the OC histotypes, high grade serous ovarian carcinoma (HGSOC) is most prevalent worldwide (70-75% of all OC cases) with ovarian clear cell carcinoma (OCCC) the second most prevalent (10-25%). Importantly though, in Asia, HGSOC accounts for only about 30-50% of OC cases while OCCC accounts for 20% or more. In Taiwan, OCCC case numbers are increasing every year. It is also concerning that OCCC tends to occur at a younger age and when it is not diagnosed until an advanced stage, it has more severe prognosis, drug resistance, metastasis and recurrence compared to other OC subtypes.
Mutations in tumor suppressor p53 are the most common genetic alternations in sporadic OC and are typically responsible for poor clinical outcome. The p53 mutation frequency in the major OC histotype HGSOC is high as 96%. In contrast, p53 mutations are present in less than 20% of advanced OCCC cases. Somehow, OCCC cells with intact p53 manage to bypass p53 tumor suppressive functions and continue tumorigenesis progression. How this occurs is unclear.
Dr. Wendy W. Hwang-Verslues at Genomics Research Center discovered that the RNA-binding protein MEX3A is a key gene that OCCC cells use to suppress p53 anti-cancer function. These results were recently published in the prestigious journal Cancer Research. “We found that MEX3A plays a key role in tumorigenic ability of OCCC cells by controlling intracellular reactive oxygen species (ROS) levels and suppressing cell death.” Dr. Hwang-Verslues explained.
The Hwang-Verslues team found that upregulation of MEX3A is critical for tumorigenesis in WT p53-expressing OC. MEX3A overexpression enhanced the growth of OCCC cell lines. In contrast, depletion of MEX3A in OCCC cells reduced cell survival and proliferative ability. MEX3A depletion also inhibited tumor growth and prolonged survival of mice implanted with human WT p53 OC cells.
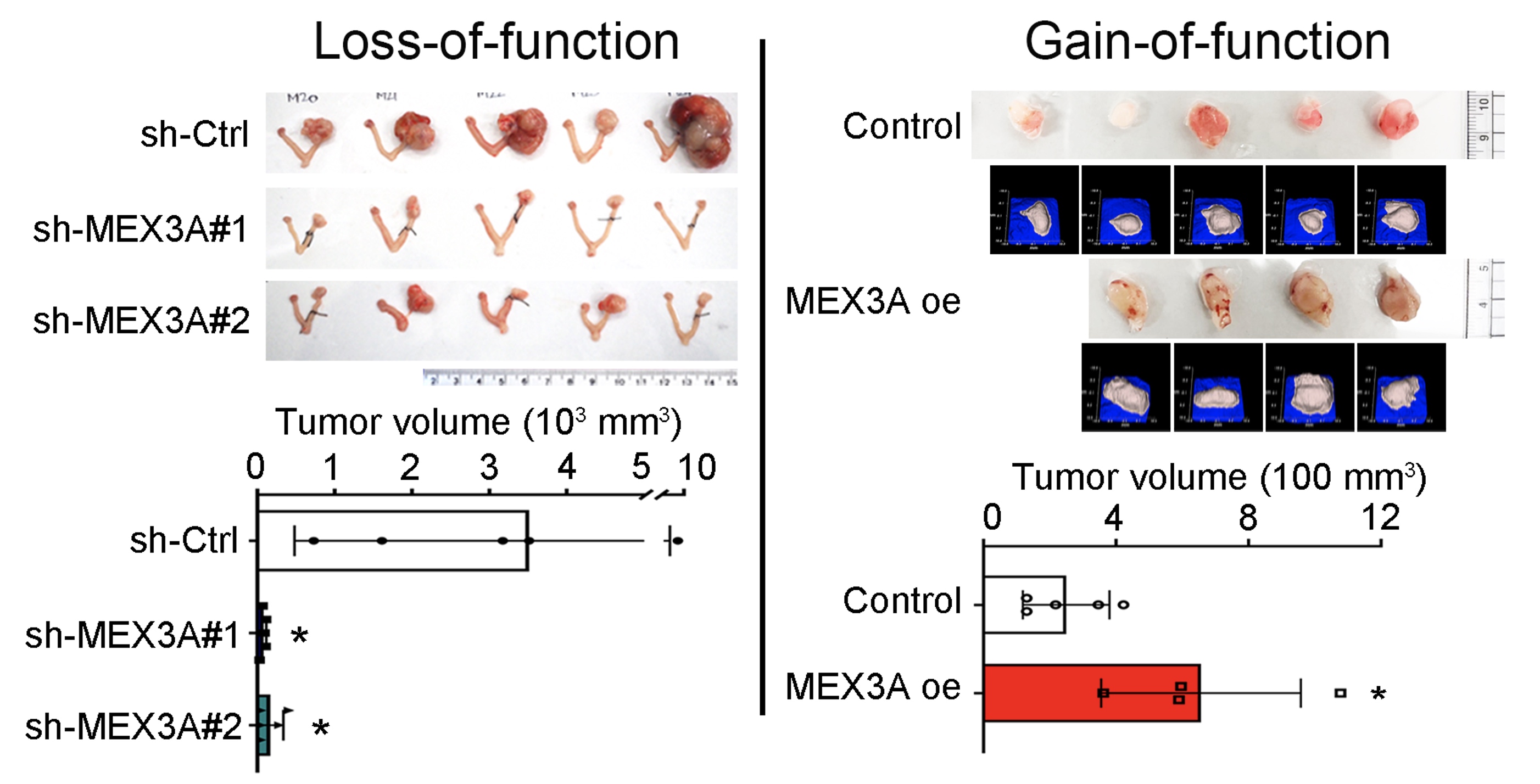 |
| Tumor growth is inhibited upon MEX3A depletion. In contrast, overexpression of MEX3A promotes tumor growth. |
In further work to determine why MEX3A has such a dramatic effect on tumorgenicity, the Hwang-Verslues team found that MEX3A suppresses p53-mediated ferroptosis. Ferroptosis is a unique iron-dependent form of programmed cell death. Recent studies have shown that ferroptosis can be regulated by p53 and contributes greatly to the function of p53 in tumor suppression. MEX3A destabilizes the p53 protein and the resulting depletion of p53 allows tumorgenesis to proceed.
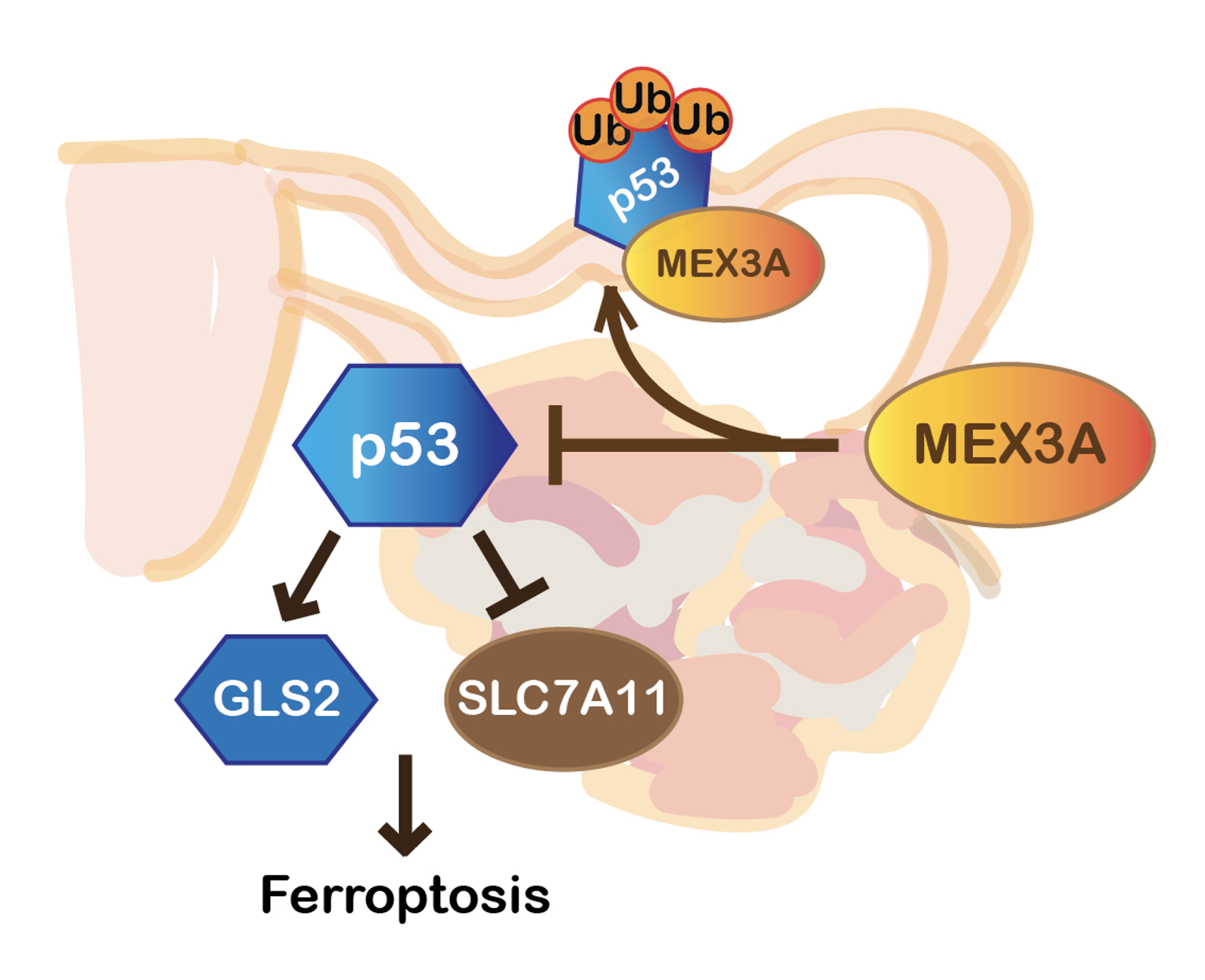 |
| MEX3A acts as a tumor promoting factor in WT p53 expressing OC which facilitates p53 protein ubiquitination and degradation to prevent ferroptosis and enhance tumorigenesis. |
These results provide insights into the mechanisms of ovarian tumorigenesis and could facilitate development of effective strategies for cancer therapy selectively targeting ovarian cancer expressing WT p53.
The paper titled “MEX3A mediates p53 degradation to suppress ferroptosis and facilitate ovarian cancer tumorigenesis” can be read online at: https://doi.org/10.1158/0008-5472.CAN-22-1159