預防變異 解析新冠病毒棘狀蛋白上中和抗體結合熱區又一突破
- 詳細內容
- 發佈:2023-01-30, 週一 10:18
新冠肺炎疫情隨著疫苗施打普及率提升與群體免疫效應等催化下日益趨緩,各國分分解封。然而近期所產生的新型變種病毒株仍具備威脅,不容小覷。面對疫情的未知發展,應付變種病毒,廣效中和抗體將成為對抗新冠肺炎病毒的最後防線。
基因體研究中心馬徹研究員與合聘教授台大醫學院黃冠穎醫師聯手合作,在最新一期《自然通訊》期刊(Nature Communications)對於新冠肺炎研究提出突破性的研究發現,經由X光繞射儀與冷凍電顯等技術,研究團隊解構出新冠病毒表面上棘狀蛋白的中和抗體結合熱區。
研究人員從台灣病例檢體中分離出八個中和性單株抗體,他們都不約而同地結合在棘狀蛋白上的受體接觸域(RBD, Receptor binding domain)的隱密區域,並將其抗原決定位(epitope)命名為”第四類抗體”;其中第一與第二類抗體結合於RBD的最上層區域,第三類抗體則結合於RBD的最外圍部分,都是屬於淺層的範疇。而第四類抗體則結合於RBD上最中間的深層區域(圖一)。
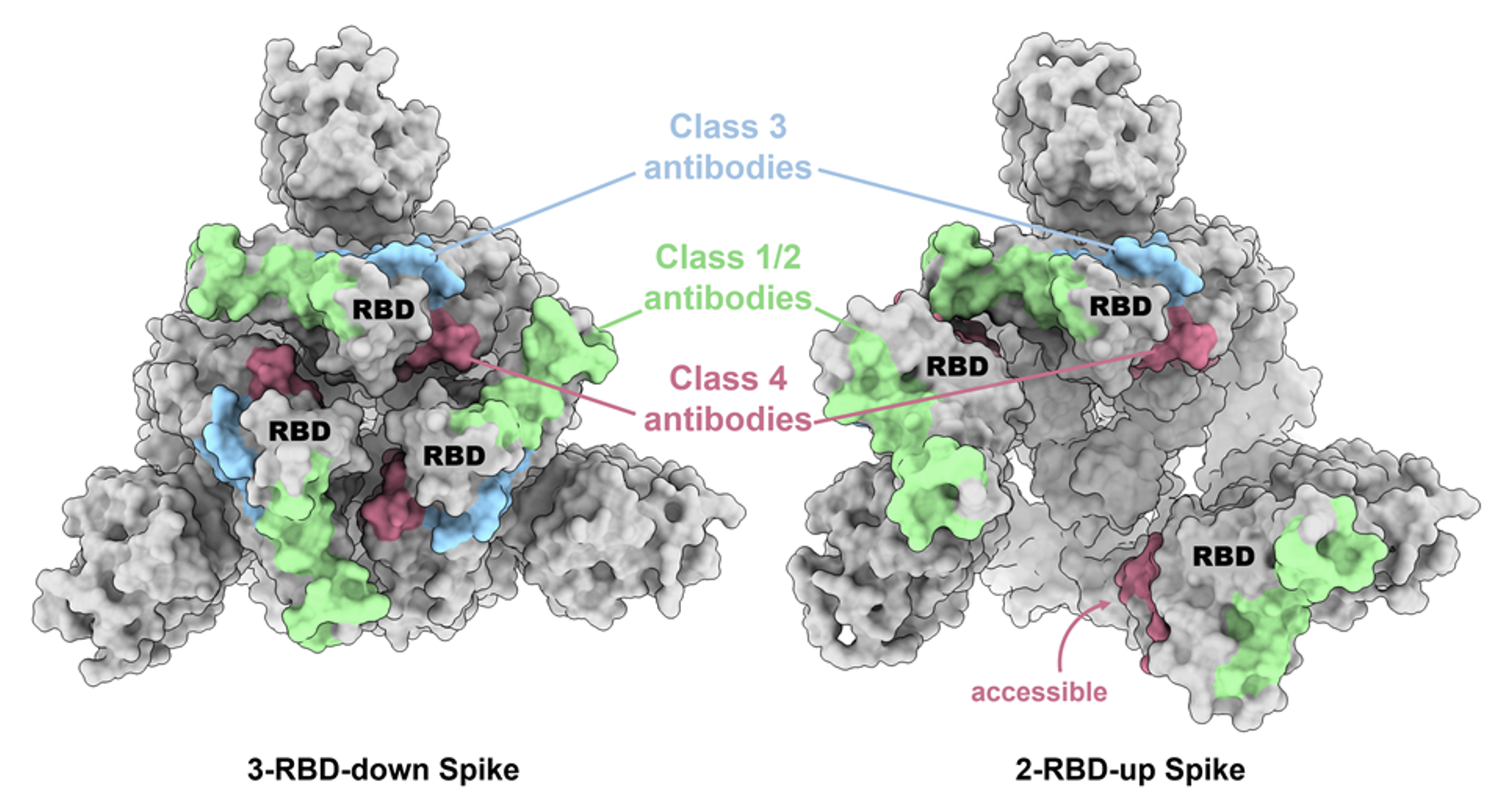 |
| 圖一:狀蛋白上的受體接觸域(RBD, Receptor binding domain) |
團隊成員也是本論文共同第一作者的陳曉蕊博士後研究學者指出,只有當RBD呈現上舉的型態時,第四類抗體方可探測到位置並與其結合,因而稱之為”隱密抗體”,也由於此區域具有高度隱密性,不易產生突變,可視為廣效性抗體決定位的熱區。
研究數據結果顯示,這些第四類抗體同樣具備不同的結合特性,一些抗體傾向結合在偏RBD下方的區域,有些則偏向第三類抗體結合的交界處(圖二)。
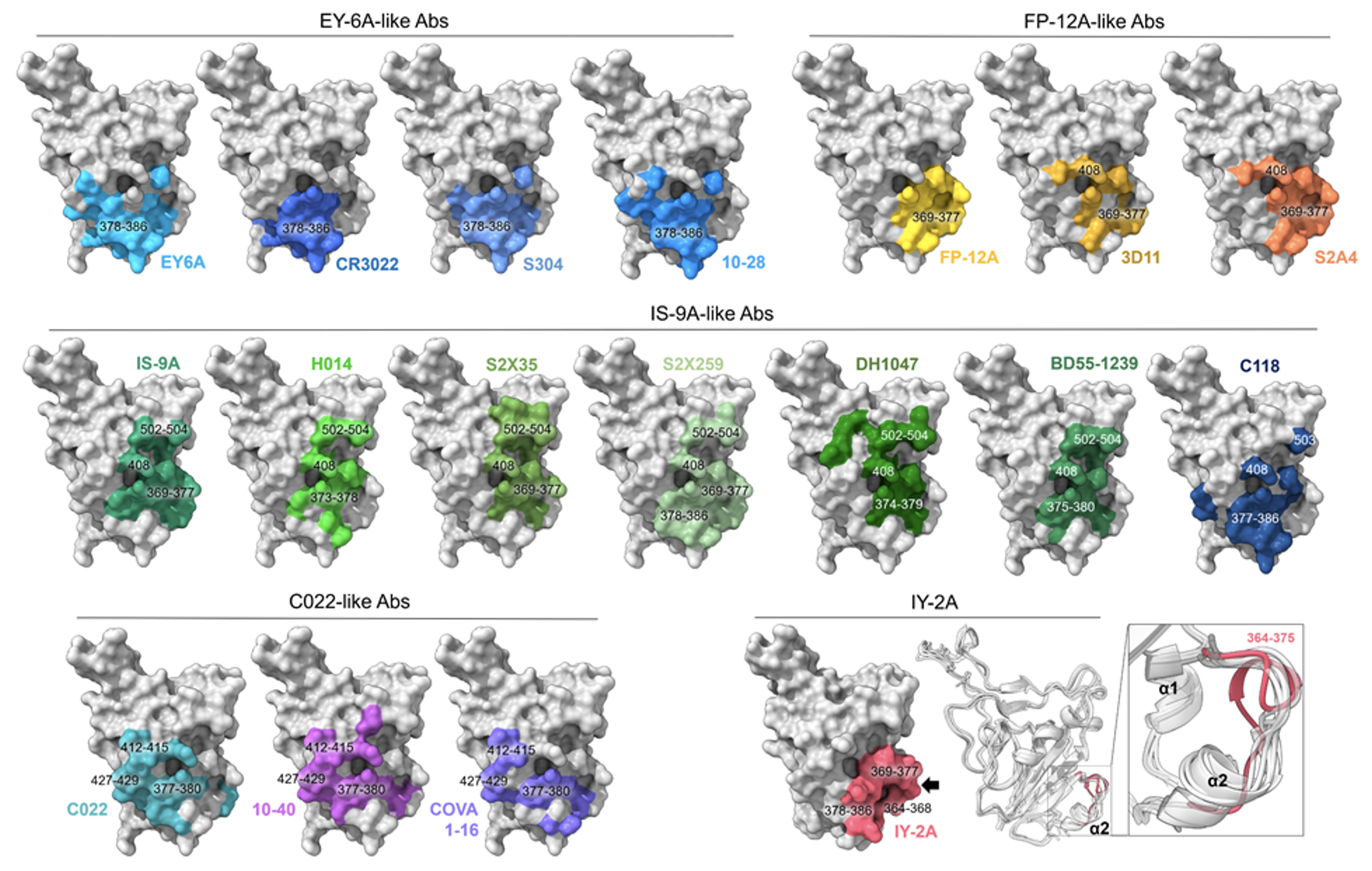 |
| 圖二:第四類抗體顯現出不同的結合特性 |
研究團隊進一步分析這八個抗體與不同新冠病毒變異株的結合強度,發現在中和性實驗中,這些抗體皆可廣泛並有效抑制Omicron BA. 5與其他既有的變種病毒株,尤其IY-2A這支抗體不單能驅使RBD產生結構型態改變,更產生新中和性結合位,已是目前在新冠研究上的最新突破發現(圖三)。
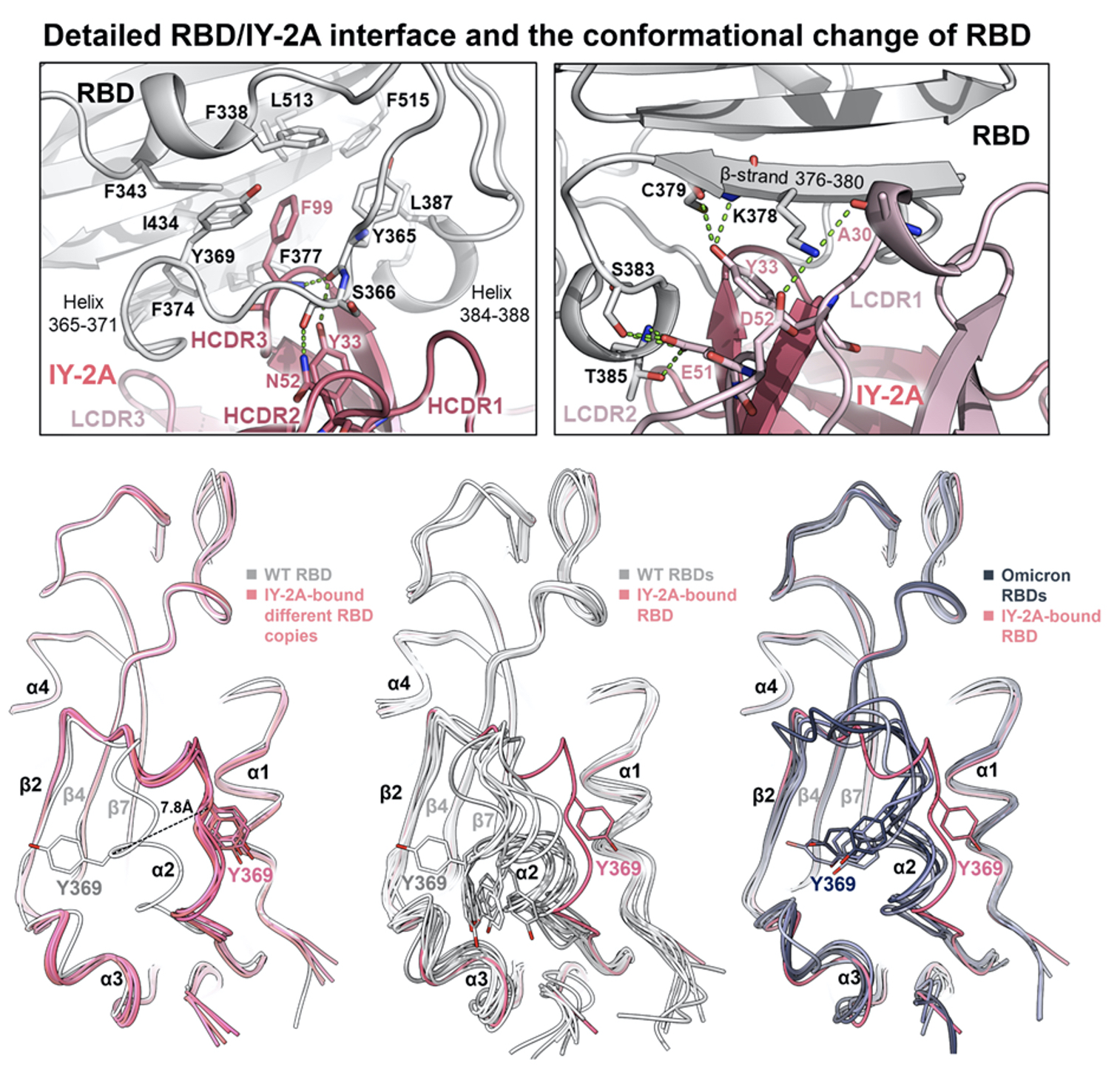 |
| 圖三:IY-2A抗體促使RBD結構型態改變進而產生新中和性結合位 |
本次研究發表詳細闡述了棘狀蛋白與抗體的蛋白質複合體結構研究,包含三個X光繞射晶體結構與三個相應的冷凍電顯結構。期望為新冠肺炎抗體新藥開發與疫苗研發提供如何優化的觀點,研究團隊在研究中也發現相較於其他種類疫苗,mRNA疫苗更能激發出第四類抗體,或許可以解釋mRNA疫苗保護力較強的原因之一。
論文全文「Structural basis for a conserved neutralization epitope on the receptor-binding domain of SARS-CoV-2」可在線上閱讀:https://www.nature.com/articles/s41467-023-35949-8